URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: Wie ein Enzym Sonnenlicht nutzt, um DNA zu reparieren
News-Suche
Meldungen vom Forschungszentrum DESY
Wie ein Enzym Sonnenlicht nutzt, um DNA zu reparieren
DNA-Schäden sind eine Ursache für Alterung, Zelltod und sogar Krebs. Die Reparatur beschädigter DNA ist daher für alle Organismen von entscheidender Bedeutung. Wie das Enzym Photolyase die Energie des Sonnenlichts für diesen Reparaturmechanismus nutzt, hat ein internationales Forschungsteam unter der Leitung von DESY und mit Forschenden der Universität Hamburg und European XFEL gemeinsam untersucht. In der Fachzeitschrift „Science“ beschreibt das Team, wie sich der Prozess mithilfe der zeitaufgelösten Kristallographie verstehen lässt.
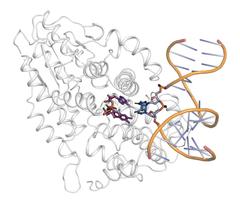
Darstellung der Struktur der Photolyase mit gebundener DNA (gelb und blau) und dem photochemisch aktiven Bereich (lila). Bild: DESY
„Um zu überleben, hat das Leben leistungsfähige DNA-Reparaturmechanismen entwickelt. Eine besonders elegante Lösung bietet das Enzym Photolyase“, erklärt DESY-Wissenschaftler Thomas J. Lane, der im Center for Free-Electron Laser Science CFEL und auch im Exzellenzcluster „CUI: Advanced Imaging of Matter“ der Universität Hamburg forscht. Das Enzym nutzt Sonnenlicht, um durch Sonnenlicht verursachte Schäden zu reparieren. Es ist in der Lage, die Stelle zu erkennen, an der die UV-Strahlung die DNA vernetzt und hält sich an den beschädigten DNA-Stücken fest. Dann kann blaues Sonnenlicht absorbiert und zur chemischen Reparatur genutzt werden. Auf diese Art bringt das Enzym die DNA wieder in ihre ursprüngliche, gesunde Form zurück.
Um die Funktionsweise der Photolyase besser zu verstehen, interessierten die Forschenden sich zunächst für die Form des Enzyms unmittelbar nach der Lichtabsorption, aber vor der Reparatur der DNA. Außerdem wollten sie die genaue Abfolge der chemischen Reaktionen herausfinden, die notwendig sind, um geschädigte DNA in gesunde DNA zu verwandeln. In einem dritten Schritt wollte das Team zudem herausfinden, wie die Photolyase spezifisch erkennen kann, welche DNA geschädigt ist.

Diese Forschung wurde erst durch die jüngste Entwicklung von Freie-Elektronen-Röntgenlasern möglich. Das Bild zeigt den Aufbau am Freie-Elektronen-Röntgenlaser SwissFEL, mit dem die ultrakurzen Röntgenpulse erzeugt wurden, die für die Untersuchung des DNA-Reparaturmechanismus benötigt werden. Foto: DESY, A. Pateras
Darüber hinaus war jahrzehntelang umstritten, ob die schädliche Vernetzung in Form zweier Kohlenstoff-Kohlenstoff-Bindungen, die am Reparaturprozess beteiligt sind, sofort oder schrittweise gebrochen wird. Die Forschenden stellten fest, dass zunächst eine der zwei Bindungen gebrochen wird, bevor die zweite folgt. Zudem wurde deutlich, dass das Enzym eine Bindungstasche hat, die perfekt an die Form der beschädigten DNA angepasst ist. Die Forschenden konnten so zeigen, dass die reparierte DNA nicht in diese Tasche passt, da sie zu groß ist und die falsche Form hat. Dies erklärt, warum die Photolyase vor allem an geschädigte DNA andockt und nicht an reparierte, gesunde DNA.
Das Team ermittelte zehn zeitaufgelöste Photolyase-Strukturen während der DNA-Reparatur. „Zusammengenommen beleuchten unsere Strukturen die Funktion eines leistungsstarken DNA-Reparatursystems, das Sonnenlicht auf elegante Weise nutzt, um durch Sonnenlicht verursachte Schäden zu reparieren“, sagt Thomas J. Lane. Dem Menschen fehlt dieses Enzym leider, so dass andere Reparaturmechanismen nötig sind. Für fast alle anderen Lebewesen spielt die Photolyase jedoch eine wichtige Rolle bei der DNA-Reparatur.
Die Arbeit wurde von folgenden Organisationen gefördert: Helmholtz-Gemeinschaft, Universität Hamburg, Schweizerischer Nationalfonds, Göran Gustafsson Stiftung, Carl-Trygger-Stiftung, Imperial College London, Exzellenzcluster „CUI: Advanced Imaging of Matter“ an der Universität Hamburg, National Science Foundation (USA), Department of Energy (USA).
Originalveröffentlichung
Time-resolved crystallography captures light-driven DNA repair; Nina-Eleni Christou et al.; Science, 2023; DOI: 10.1126/science.adj4270



