URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: DESYs Röntgenquelle PETRA III weist mögliche Wege zu besseren RNA-Impfstoffen
News-Suche
Meldungen vom Forschungszentrum DESY
DESYs Röntgenquelle PETRA III weist mögliche Wege zu besseren RNA-Impfstoffen
Das Mainzer Biotech-Unternehmen BioNTech, das kürzlich mit dem US-Konzern Pfizer erste positive Ergebnisse für einen Corona-Impfstoff vorgestellt hat, forscht an DESYs Röntgenquelle PETRA III bereits an der nächsten Generation von RNA-Wirkstoffen. An der vom Europäischen Molekularbiologie-Laboratorium EMBL betriebenen Messstation P12 hat die Firma zusammen mit den Universitäten Mainz, Tel Aviv und Leiden sowie dem Forschungszentrum Jülich und EMBL untersucht, wie sich die sogenannte Boten-RNA (messenger RNA; mRNA) besser verpacken lässt und damit eine bessere Wirkung im Zielorganismus entfalten kann. Über eine Reihe von Ergebnissen berichten die Forscherinnen und Forscher in drei Veröffentlichungen in den Fachjournalen „Applied Nano Materials“, „Cells“ und „Langmuir“. Die Arbeiten illustrieren auch das Potenzial der Analytik mit Hilfe der Forschungsinfrastrukturen auf dem DESY-Campus.
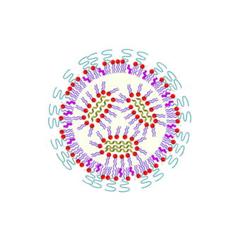
Diese Methode ist sehr vielseitig und ermöglicht somit schnelle Reaktionen auf Ausbrüche von Epidemien. Ebenso ist es möglich, Antigene bestimmter Krebszellen vom Körper produzieren zu lassen, um damit eine Immunreaktion gegen diese Krebszellen hervorzurufen. Im Prinzip lässt sich die Bauanleitung jedes Proteins in den Körper einschleusen, nicht nur solche von Krankheitserregern und Krebszellen, sondern auch von Proteinen, die für die Behandlung bestimmter Krankheiten nützlich sind. Als Bauanleitung dient dabei in der Regel die Boten-RNA. Diese mRNA wird in der Zelle normalerweise vom DNA-Erbgutstrang abgelesen und dann in der Proteinfabrik der Zelle, dem Ribosom, in Proteine umgesetzt. Bei der RNA-Impfung wird fertige mRNA von außen in die Zellen eingeschleust und direkt vom Ribosom verarbeitet. Das eigene Erbgut im Zellkern bleibt unverändert, und die eingeschleuste mRNA wird zügig abgebaut, so dass die Produktion des Erreger-Proteins auch bald wieder zum Erliegen kommt.
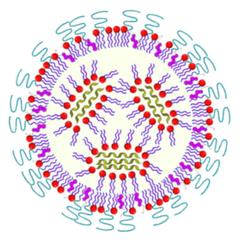
Das Einschleusen der mRNA ist allerdings eine große Herausforderung. Reine mRNA würde im Gewebe von allgegenwärtigen Enzymen abgebaut und gar nicht erst in Zellen aufgenommen. Es gibt daher verschiedene Strategien, die Boten-RNA in Nanopartikeln zu verstecken und so in die Körperzellen zu schleusen. In der Regel wird die mRNA dazu mit Nanopartikeln aus bestimmten Polymeren oder sogenannten Lipiden eingeschleust, das sind Moleküle, aus denen zum Beispiel die Zellmembranen aufgebaut sind.
Bei richtiger Konfiguration bilden sich Nanopartikel, die von den Körperzellen aufgenommen werden, wo schließlich die mRNA freigesetzt wird. Die Effizienz dieser sogenannten Transfektion ist entscheidend für die Wirksamkeit eines RNA-Impfstoffs. An PETRA III haben die Forscherinnen und Forscher verschiedene neue Ansätze für die Verpackung und Auslieferung der mRNA untersucht.
Unter anderem entwickelten die Wissenschaftlerinnen und Wissenschaftler mRNA-Lipidnanopartikel (LNPs), die mit Hilfe eines Polymers, das aus der körpereigenen Aminosäure Sarkosin aufgebaut ist, für diesen Zweck maßgeschneidert wurden. Üblicherweise wird dafür Polyethylenglykol (PEG) verwendet, ein in der Pharmazie und der Kosmetikindustrie weit verbreitetes Polymer, das aber verschiedene Nachteile aufweist. Die neue Variante der LNPs führte zu einer hohen Produktion des gewünschten Proteins und verringerte gleichzeitig unerwünschte Immunreaktionen, wie das Team in „Applied Nano Materials“ berichtet.

An weiteren Lipid-Modellsystemen untersuchten die Wissenschaftlerinnen und Wissenschaftler, wie die innere Struktur von LNPs auf unterschiedliche pH-Werte reagiert. Dies ist wichtig, da bei einem entscheidenden Schritt der Aufnahme und Freisetzung in der Zelle eine Änderung des pH-Werts eine wesentliche Rolle spielt. Für den Aufbau der LNPs kommen daher sogenannte ionisierbare Lipide zum Einsatz, die ihren Ladungszustand mit dem pH-Wert ändern. Die Einstellung des genauen pH-Werts, bei dem die Ladungsänderung stattfindet, gilt als wesentliche Grundlage für eine hohe Wirksamkeit der LNPs.
Bisher konnten solche pH-Wert-abhängigen Änderungen nur indirekt, zum Beispiel mit spektroskopischen Methoden untersucht werden. Dem Team ist es nun erstmals gelungen, auch die Strukturänderungen in Modellmembranen mit den ionisierbaren Lipiden direkt nachzuweisen. Die im Journal „Langmuir“ veröffentlichte Arbeit beschreibt, wie der pH-Wert die innere Ordnung der Nanopartikel beeinflusst. Dieses Wissen lässt sich für die Entwicklung optimierter Transportsysteme zur Transfektion bestimmter Zelltypen verwenden, da sich die pH-Bedingungen je nach Zelltyp unterscheiden.
Auch durch die richtige Kombination unterschiedlicher Materialien für den Aufbau der Nanopartikel lässt sich die Effizienz der mRNA-Transfektion erhöhen, wie eine weitere Untersuchung zeigt. Hybrid-Nanopartikel, die sowohl Lipide als auch Polymere enthielten und in geeigneter Weise aufgebaut wurden, erreichten eine deutlich bessere Transfektion als reine Lipid- oder reine Polymer-Nanopartikel, schreiben die Forscherinnen und Forscher im Fachblatt „Cells“. Strukturanalysen unter anderem an der EMBL-Messstation P12 an PETRA III zeigten dabei, dass die Partikelarten mit der höchsten Transfektionseffizienz durch eine heterogene innere Organisation gekennzeichnet sind, bei der sich geordnete und weniger geordnete Bereiche in charakteristischer Weise abwechseln. Sie weisen damit eine gewisse Ähnlichkeit zu den aus den Materialwissenschaften bekannten Kompositmaterialien auf.
Alle drei Ansätze eröffnen Möglichkeiten, die Grundlagen der Wirksamkeit von mRNA-Präparaten besser zu verstehen und damit künftige mRNA-Impfstoffe zu weiter zu verbessern und sie gezielt für bestimmte Anwendungen zu optimieren. Die Transfektion ist ein entscheidender Faktor für den Erfolg von mRNA-Impfstoffen, in die gegenwärtig große Hoffnungen gesetzt werden. So arbeiten neben BioNTech und Pfizer sowie Moderna auch weitere Firmen wie etwa das Tübinger Unternehmen Curevac an Corona-Impfstoffen auf mRNA-Basis. Auch wenn weitere Aspekte wie die längerfristige Wirksamkeit noch untersucht werden müssen, gibt dies bereits einen Ausblick auf das Potenzial dieser Technik, mit der sich im Prinzip sehr schnell Impfstoffe gegen verschiedene Infektionskrankheiten entwickeln lassen könnten, aber auch therapeutische Impfungen zur Behandlung bestehender Krankheiten wie etwa Krebs.
Die Arbeiten zeigen, welche herausragenden Untersuchungs- und Experimentiermöglichkeiten die Forschungsinfrastruktur auf dem DESY-Campus bietet, um Fortschritte in Innovation, Technik und Medizin zu erreichen. In Krisenzeiten wie der aktuellen Corona-Pandemie hat insbesondere die Analytik eine hohe Relevanz. Diese Analytik kann wichtige Erkenntnisse liefern, die gezielt auf Produktentwicklungen im Wirkstoffbereich einzahlen. Dieses Potenzial ist längst noch nicht ausgeschöpft.
Originalveröffentlichungen:
Hybrid Biopolymer and Lipid Nanoparticles with Improved Transfection Efficacy for mRNA; Christian D. Siewert, Heinrich Haas, Vera Cornet, Sara S. Nogueira, Thomas Nawroth, Lukas Uebbing, Antje Ziller, Jozef Al-Gousous, Aurel Radulescu, Martin A. Schroer, Clement E. Blanchet, Dmitri I. Svergun, Markus P. Radsak, Ugur Sahin and Peter Langguth; „Cells“, 2020; DOI: 10.3390/cells9092034
Polysarcosine-Functionalized Lipid Nanoparticles for Therapeutic mRNA Delivery; Sara S. Nogueira, Anne Schlegel, Konrad Maxeiner, Benjamin Weber, Matthias Barz, Martin A. Schroer, Clement E. Blanchet, Dmitri I. Svergun, Srinivas Ramishetti, Dan Peer, Peter Langguth, Ugur Sahin, and Heinrich Haas; „Applied Nano Materials“, 2020; DOI: 10.1021/acsanm.0c01834
Investigation of pH-Responsiveness inside Lipid Nanoparticles for Parenteral mRNA Application Using Small-Angle X‐ray Scattering; Lukas Uebbing, Antje Ziller, Christian Siewert, Martin A. Schroer, Clement E. Blanchet, Dmitri I. Svergun, Srinivas Ramishetti, Dan Peer, Ugur Sahin, Heinrich Haas, and Peter Langguth; „Langmuir“, 2020; DOI: 10.1021/acs.langmuir.0c02446