URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: Den Geheimnissen des Malariaparasiten auf der Spur
News-Suche
Meldungen vom Forschungszentrum DESY
Den Geheimnissen des Malariaparasiten auf der Spur
Ein Forschungsteam hat erstmals ein Protein aus der Gruppe der Lipocaline im Malariaparasiten Plasmodium falciparum identifiziert. Die Entdeckung hilft, den Lebenszyklus des Parasiten besser zu verstehen, der in weiten Teilen der Erde zu den größten Gesundheitsbedrohungen gehört. Die Kooperation der Gruppen von Tim Gilberger vom Zentrum für Strukturelle Systembiologie CSSB (Abteilung Zelluläre Parasitologie Bernhard-Nocht-Institut für Tropenmedizin/Universität Hamburg) bei DESY und Matthias Wilmanns von der Hamburger Außenstelle des Europäischen Molekularbiologie-Laboratoriums EMBL berichtet über seine Entdeckung im Fachblatt „Cell Reports“. Das CSSB ist eine Kooperation von neun Institutionen, darunter DESY, die Mitarbeiterinnen und Mitarbeiter an das Zentrum entsandt haben.

Lipocaline sind eine Familie von trichterförmigen Proteinen, die wasserunlösliche Moleküle wie Lipide und Steroide in Zellen schleusen. Sie kommen in fast jedem Organismus vor, haben zahlreiche Funktionen und weisen eine extreme Vielfalt auf, wodurch sie schwer zu identifizieren sind. Im Malariaparasiten waren keine Lipocaline bekannt. Gilbergers Gruppe konzentrierte sich auf ein einzelnes Gen, von dem vermutet wurde, dass es den Bauplan für ein Lipocalin darstellt.
Um dies zu validieren, tat sich die Gruppe mit dem Team von Wilmanns zusammen.„Die Primärstruktur der Lipocaline ist sehr unterschiedlich, aber alle Mitglieder der Familie haben eine ähnliche Kristallstruktur“, erläutert Ko-Autor Thomas Crosskey vom EMBL. „Die Untersuchung des Proteins per Röntgenkristallographie an der Beamline P13 von PETRA III zeigte eine Struktur aus je vier Proteinen mit einer klassischen Lipocalin-Faltung und bestätigte damit, dass es sich um ein Lipocalin handelt.“ Das Protein erhielt die Bezeichnung P. falciparum Lipocalin (PfLCN).
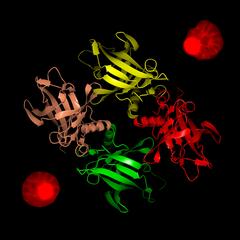
„Während seines Wachstums innerhalb der roten Blutkörperchen befindet sich der Parasit in einer parasitophoren Vakuole und ernährt sich vom Hämoglobin der Wirtszelle, das in einer anderen Vakuole, der sogenannten Nahrungsvakuole, verstoffwechselt wird", erklärt Hauptautor Paul-Christian Burda vom Bernhard-Nocht-Institut. „Wir konnten zeigen, dass PfLCN in beiden dieser Vakuolenkompartimente lokalisiert.“
Nach der Identifizierung, Bestätigung und Lokalisierung des Lipocalins untersuchten die Wissenschaftlerinnen und Wissenschaftler die Funktion des Proteins innerhalb des Parasiten. „Zuerst mussten wir herausfinden, ob PfLCN eine wesentliche Rolle bei der Vermehrung des Parasiten im Blutstadium spielt“, sagt Burda. „Dazu haben wir PfLCN aus dem Parasiten entfernt und konnten beobachten, dass sich der Parasit ohne das Lipocalin in der Wirtszelle nicht mehr vermehren kann.“
Die Lokalisierung des Proteins in den Vakuolen gibt dabei einen Hinweis auf eine mögliche Funktion dieses Lipocalins, da die Vakuolen für oxidative Schäden anfällige intrazelluläre Grenzflächen darstellen. Daher brachten die Forscherinnen und Forscher den modifizierten Parasiten mit einem Radikalfängermolekül zusammen. „Überrascht haben wir beobachtet, dass dies zu einer teilweisen Rettung führte“, berichtet Gilberger. „Das deutet darauf hin, dass PfLCN auch eine Rolle für die Reduzierung von oxidativem Zellschäden im Malariaparasiten spielen könnte.“ Als nächstes möchte Gilbergers Gruppe untersuchen, woran PfLCN genau bindet und wie es mit Molekülen wie Lipiden oder anderen hydrophoben Verbindungen interagiert.
Die Kooperation hat nicht nur einen kleinen Teil des Rätsels aufgeklärt, wie P. falciparum sein Überleben in den roten Blutkörperchen sichert, sondern zeigt auch, wie die Kombination komplementärer Methoden zu einem umfassenderen Verständnis der Struktur und Funktion von Proteinen führen kann. „Das CSSB wurde gegründet, um Wissenschaftlerinnen und Wissenschaftlern die Möglichkeit zu geben, die Stärken der Röntgenkristallographie an PETRA III mit komplementären Mikroskopietechniken zu kombinieren, damit sie zentrale Fragen der Infektionsbiologie beantworten können“, erklärt CSSB-Gründungsdirektor Wilmanns.
Originalveröffentlichung:
„Structure-Based Identification and Functional Characterization of a Lipocalin in the Malaria Parasite Plasmodium falciparum“; Paul-Christian Burda, Thomas Crosskey, Katharina Lauk, Aimo Zurborg, Christoph Söhnchen, Benjamin Liffner, Louisa Wilcke, Emma Pietsch, Jan Strauss, Cy M. Jeffries, Dmitri I. Svergun, Danny W. Wilson, Matthias Wilmanns, Tim-Wolf Gilberger; Cell Reports, 2020; DOI: 10.1016/j.celrep.2020.107817



