URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: Röntgenuntersuchung enthüllt wichtigen Mechanismus bei parkinsonartigen Erkrankungen
News-Suche
Meldungen vom Forschungszentrum DESY
Röntgenuntersuchung enthüllt wichtigen Mechanismus bei parkinsonartigen Erkrankungen
Eine neue Röntgenstudie enthüllt einen zentralen Mechanismus bei bestimmten erblichen parkinsonartigen Erkrankungen. Die Untersuchung zeigt detailliert, wie die Vergiftung mit dem Metall Mangan in der Zelle abläuft, die zu parkinsonartigen Symptomen führt. Das Mangan sammelt sich demnach bei einem speziellen Gendefekt im sogenannten Golgi-Apparat in der Zelle an. Das haben Untersuchungen bei DESY sowie an der Europäischen Synchrotron-Strahlungsquelle ESRF im französischen Grenoble gezeigt, wie Forscher um Richard Ortega von der Universität Bordeaux im Fachblatt „ACS Chemical Neuroscience“ berichten. „Ein genaues Verständnis dieser Manganvergiftungen ist ein entscheidender Schritt, um eine mögliche Therapie entwickeln zu können“, betont Ortega.
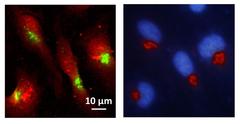
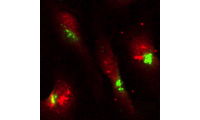
Röntgenfluoreszensaufnahme (links) der Verteilung von Mangan (grün) in den untersuchten Zellen (rot). Die Epifluoreszenzaufnahme (rechts) zeigt, dass das Mangan sich vor allem im Golgi-Apparat (rot) ansammelt, der Zellkern ist blau dargestellt. Bild: CNRS, Richard Ortega
Die Forscher um Ortega hatten eine Mutation im Gen SLC30A10 untersucht, die zuvor bei einer Reihe von familiären Parkinsonismusfällen aufgefallen war und offensichtlich zu vererbten Erkrankungen führen kann. „SLC30A10 ist für den Mangan-Transport aus der Zelle hinaus verantwortlich“, erläutert Ko-Autor Somshuvra Mukhopadhyay von der Universität von Texas in Austin, der diese Funktion des Gens und des zugehörigen Proteins in einer früheren Studie identifiziert hatte. „Bei der mutierten Form ist dieser Transport gestört und es kommt zu giftigen Konzentrationen des Metalls in der Zelle.“
Die Wissenschaftler wollten herausfinden, wo sich das Mangan in der Zelle genau ansammelt. „Mit einem feinen Röntgenstrahl, der das Metall fluoreszieren lässt, haben wir eine Vielzahl mutierter und unmutierter Zellen abgerastert“, berichtet Ko-Autorin Kathryn Spiers von der Messstation P06 an DESYs Röntgenlichtquelle PETRA III, wo die ersten Untersuchungen stattgefunden haben. „Dabei leuchtete Mangan vor allem im Golgi-Apparat mutierter Zellen auf“, ergänzt Projektleiterin Asuncion Carmona aus Ortegas Gruppe. Der Golgi-Apparat ist eine Zell-Organelle und funktioniert wie eine Versandzentrale für Proteine: Sie empfängt die Eiweißmoleküle aus dem Endoplasmatischen Retikulum, baut manche davon noch etwas um und versieht sie mit einer Art Adressaufkleber für den Transport. Verschickt werden die Proteine dann in kleinen Bläschen, den sogenannten Vesikeln.
Die Zieladresse kann innerhalb und außerhalb der Zelle liegen. Weitere Untersuchungen an der Europäischen Synchrotronstrahlungsquelle ESRF zeigten, dass sich das Mangan vor allem in den Transportvesikeln anreichert. Die Forscher vermuten, dass dadurch insbesondere der Proteintransport aus der Zelle hinaus gestört und so die Nervenfunktion beeinträchtigt wird, was zu den beobachteten parkinsonartigen Symptomen führt. In gesunden Zellen ließ sich eine entsprechende Anreicherung des Metalls im Golgi-Apparat nicht feststellen.
„Diese Arbeit hat besonders von den Möglichkeiten der verschiedenen Forschungslichtquellen profitiert“, betont Gerald Falkenberg, Leiter der DESY-Messstation P06. „Während wir die Folgen der Genmutation zunächst bei DESY aufgeklärt haben, wo sich mit dem hellen Strahl von PETRA III an unserem Versuchsaufbau eine große Zahl gesunder und mutierter Zellen schnell abrastern ließ, konnten wir anschließend mit höchstauflösenden Messungen an wenigen mutierten Zellen an der ESRF den genauen Ort der Mangan-Ablagerungen einkreisen.“
Bislang haben die Forscher erst eine von mehreren bekannten Mutationen in dem fraglichen Gen untersucht. Dazu verwendeten sie sogenannte HeLa-Zellen. Diese Zelllinie ist in der Forschung extrem weit verbreitet und eine Art Standard für Zelluntersuchungen. HeLa-Zellen sind für ein großes Untersuchungsspektrum eingesetzt worden, vom Test des Polio-Impfstoffs über die Genkartierung bis hin zu Produkttests. Es handelt sich allerdings nicht um Nervenzellen, sondern um Zellen aus dem Grenzgewebe (Epithel) einer Krebsgeschwulst. Es wäre daher interessant, diese Mangananreicherung als nächstes krankheitsnäher zu untersuchen, beispielsweise an entsprechend genmutierten Nervenzellen, betonen die Wissenschaftler.
Originalarbeit:
SLC30A10 Mutation Involved in Parkinsonism Results in Manganese Accumulation within Nanovesicles of the Golgi Apparatus; A. Carmona, C.E. Zogzas, S. Roudeau, F. Porcaro, J. Garrevoet, K.M. Spiers, M. Salomé, P. Cloetens, S. Mukhopadhyay, R. Ortega; „ACS Chemical Neuroscience“, 2018; DOI: 10.1021/acschemneuro.8b00451