URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: Röntgenblitze entschlüsseln Struktur von Virus-Kokon
News-Suche
Meldungen vom Forschungszentrum DESY
Röntgenblitze entschlüsseln Struktur von Virus-Kokon
Mit Hilfe intensiver Röntgenblitze hat ein internationales Forscherteam die kristalline Proteinhülle eines Insektenvirus entschlüsselt. Die Analyse zeigt die Bausteine des Virus-Kokons mit einer Detailgenauigkeit von 0,2 Nanometern (millionstel Millimetern) – das entspricht nahezu atomarer Auflösung. Die winzigen Viruskapseln sind die mit Abstand kleinsten Proteinkristalle, die Forscher je mit Hilfe der Röntgenkristallographie entschlüsselt haben. Das eröffnet neue Möglichkeiten für die Untersuchung von Proteinstrukturen, wie das Team um den Leitenden DESY-Forscher Prof. Henry Chapman vom Center for Free-Electron Laser Science in den „Proceedings“ der US-Akademie der Wissenschaften („PNAS“) berichtet.
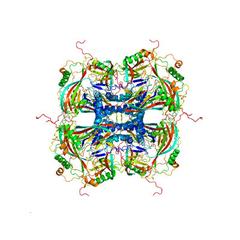
Atomares Modell der kristallinen Proteinhülle der Granuloviren, berechnet aus den aufgenommenen Röntgenbeugungsmustern. Die einzelnen Proteinmoleküle (ganz rechts) fügen sich zu Kristallbausteinen (links von der Seite gesehen, in der Mitte von oben gesehen) zusammen. Bild: Dominik Oberthür, CFEL/DESY
Forscher interessieren sich für die räumliche Struktur von Proteinen und anderen Biomolekülen, weil sich dadurch deren Funktionsweise erschließen lässt. Daraus hat sich ein eigener Wissenschaftszweig entwickelt, die Strukturbiologie. „In den vergangenen 50 Jahren haben Wissenschaftler mehr als 100 000 Proteinstrukturen entschlüsselt“, betont Chapman, der auch Physikprofessor an der Universität Hamburg ist. „Das mit Abstand wichtigste Werkzeug dabei ist die Röntgenkristallographie.“ Bei dieser Methode wird ein Kristall aus dem zu untersuchenden Protein gezüchtet und mit hellem Röntgenlicht beleuchtet. Es entsteht ein charakteristisches Muster der gebeugten Röntgenstrahlen, aus dem sich die räumliche Struktur des untersuchten Kristalls und seiner Bausteine berechnen lässt.

„Die eiförmigen Okklusionskörper des Granulovirus sind die kleinsten Proteinkristalle, die je für die Röntgen-Strukturanalyse benutzt worden sind“, erläutert Gati. Diese Virus-Kokons haben ein Volumen von etwa 0,01 Kubik-Mikrometer, das ist rund Hundert Mal weniger als die kleinsten künstlich gezüchteten Proteinkristalle, die bislang mit der Kristallographie analysiert werden konnten.
Je kleiner ein Kristall ist, desto heller muss das Röntgenlicht sein, mit dem er beleuchtet wird, um ein ausreichend detailliertes Streubild aufnehmen zu können. Die intensivsten Röntgenblitze erzeugen sogenannte Freie-Elektronen-Laser, in denen ein Strahl extrem schneller Elektronen durch eine magnetische Slalomstrecke gelenkt wird und dabei laserartiges Röntgenlicht aussendet.

Die rasterelektronenmikroskopische Aufnahme zeigt die homogene Größe der Garnulovirus-Partikel. Das Sichtfeld beträgt etwa 5 Mikrometer. Bild: Peter Metcalf, University of Auckland
Die Röntgenstrahlungsdosis war auch für die Viruskristalle vernichtend – sie verdampften in den Blitzen. Allerdings sind die Blitze so kurz, dass sie die Strukturinformation des unbeschädigten Kristalls zum Detektor befördern, bevor das Viruspartikel explodiert. Die Analyse der aufgezeichneten Streubilder zeigt, dass selbst die winzigen Proteinkristalle trotz der extrem hohen Strahlungsdosis auf diese Weise ihre Struktur in atomarer Auflösung preisgeben.
„Simulationen auf Grundlage unserer Messungen ergeben, dass wir mit unserer Methode voraussichtlich selbst die Struktur von noch kleineren Kristallen aus lediglich einigen hundert oder tausend Molekülen entschlüsseln könnten“, berichtet Chapman, der auch Mitglied im Hamburger Center for Ultrafast Imaging (CUI) ist. „Damit schaffen wir einen großen Schritt in Richtung unseres Ziels, der Analyse von Einzelmolekülen.“
An der Studie waren auch die European XFEL GmbH in Schenefeld, das Max-Planck-Institut für medizinische Forschung in Heidelberg, die Arizona State University (USA) und die Universität Basel (Schweiz) beteiligt.
Originalveröffentlichung:
Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser; Cornelius Gati et al.; „PNAS“, 2017; DOI: 10.1073/pnas.1609243114