URL: https://www.desy.de/aktuelles/news_suche/index_ger.html
Breadcrumb Navigation
DESY News: Supermikroskop für Proteinkristalle
News-Suche
Meldungen vom Forschungszentrum DESY
Supermikroskop für Proteinkristalle
Ein neuartiges Mikroskop kann selbst kleinste Proteinkristalle aufspüren, die sich auch mit modernen Lichtmikroskopen nicht mehr sichtbar machen lassen. Das innovative Verfahren nutzt verschiedene nichtlineare optische Effekte, um auch noch Nanokristalle abzubilden, die heute vermehrt zur Proteinanalyse verwendet werden. Das Entwicklerteam um Franz Kärtner von DESY, Christian Betzel von der Universität Hamburg und Guoqing Chang von der Chinesischen Akademie der Wissenschaften stellt sein „multimodales Multiphotonenmikroskop“ im Fachblatt „Communications Biology“ vor.
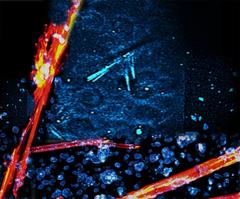
Je heller und fokussierter das Röntgenlicht ist, desto kleinere Kristalle genügen für die Strukturanalyse. Das ist ein großer Vorteil, denn viele Proteine lassen sich nur widerwillig in Kristallform zwingen, weil dies in ihrer natürlichen Umgebung nicht vorkommen soll. Aus solchen Proteinen wachsen oft nur winzigste Kristalle. „Mit den immer besseren Röntgenlichtquellen steigt der Bedarf an Mikro- und Nanokristallen“, erläutert Betzel, der wie Kärtner auch Mitglied des Hamburg Centre for Ultrafast Imaging CUI ist.
Das Problem: Die Forscherinnen und Forscher müssen diese winzigen Kristalle in der Suspension erst einmal finden. Die Proteinkristalle sind jedoch nicht nur klein, sondern in der Regel auch durchsichtig und Salzkristallen nicht unähnlich. „Bei der Detektion dieser sehr kleinen Kristalle stößt man selbst unter Anwendungen sehr moderner Mikroskope seit Jahren an Grenzen“, betont Kärtner, der im Center for Free-Electron Laser Science CFEL arbeitet, einer gemeinsamen Einrichtung von DESY, Universität Hamburg und der Max-Planck-Gesellschaft. „Diese meist farblosen Proteinkristalle lassen sich in wässrigen Lösungen bei der Vorbereitung zu Messungen extrem schwer auffinden und werden oft übersehen“, ergänzt Qing-di Cheng, eine der beiden Hauptautorinnen und Doktorandin an der Universität Hamburg.

Aufbau des multimodalen Multiphotonenmikroskops im Labor mit eingezeichneten Laser-Strahlwegen: Die Laserquelle befindet sich in der Mitte des Bildes. Der Strahl wird dann aufgespalten und in zwei unterschiedliche Wellenlängen konvertiert, die am Ende wieder vereint werden und durch den senkrechten Tubus auf die Probe gelenkt werden. Bild: DESY
Das neue Multiphotonenmikroskop nutzt einen speziell entwickelten mehrfarbigen Faserlaser der intensive ultrakurze Laserblitze von nur einem Zehntel einer billionstel Sekunde (einer zehntel Pikosekunde) Dauer im Infrarotbereich erzeugt. Diese Pulse haben eine Wellenlänge von zunächst 1550 Nanometern. Durch eine Frequenzverdopplung erzeugt das System Laserpulse mit der halben Wellenlänge von 775 Nanometern, das liegt knapp außerhalb des sichtbaren Spektrums im nahen Infrarot. Zugleich produziert das System durch eine nichtlineare Wellenlängenkonversion Laserpulse mit 1300 Nanometern Wellenlänge. Mit beiden Pulsen wird die Probe beleuchtet.
„Das Multiphotonenmikroskop, das von einer solchen faserbasierten ultraschnellen Quelle getrieben wird, dient als eine robuste und kostengünstige Lösung für die Erkennung von Proteinkristallen durch Frequenzverdopplung, Frequenzverdreifachung, und Drei-Photonen-Fluoreszenz“, sagt Hsiang-Yu Chung, Postdoktorand am CFEL und der andere Hauptautor der Veröffentlichung.

In biologischen Zellen gewachsene PAK4-Proteinkristalle, die unter dem optischen Mikroskop gerade noch erkennbar sind (links), im Licht der zweiten (SHG, Mitte) und dritten Harmonischen (THG, rechts) bestätigen die Funktion der Methode. Bild: Cheng, Q., Chung, H., Schubert, R. et al., Commun Biol, Linkhttps://doi.org/10.1038/s42003-020-01275-8
Die kürzere Wellenlänge ist zudem so gewählt, dass sie bei der Aminosäure Tryptophan, die in Proteinen vorkommt, eine Fluoreszenz auslösen kann. Dazu müssen Elektronen in dieser Aminosäure jeweils gleich drei Photonen (Lichtteilchen) auf einmal aus dem Laserblitz absorbieren. Das ist möglich, wenn die Dichte der Laserphotonen groß genug ist. Dazu wird der Laser scharf fokussiert. Nur im Fokus kann diese Mehrfachabsorption stattfinden, von der Multiphotonenmikroskope ihren Namen haben. Bei dem neuen Proteinmikroskop liegt die resultierende Fluoreszenz wiederum im UV-Bereich, während das eingestrahlte Laserlicht aus dem Infrarotbereich stammt. So lässt sich das erzeugte vom eingestrahlten Licht gut trennen und das Leuchten der Proteinkristalle zuverlässig nachweisen.
Im Labor konnte die Technik ihre Funktion bei Suspensionen mit verschiedenen Mikrokristallen unter Beweis stellen. Winzige Kristalle aus den Proteinen Lysozym, Thaumatin, Thermolysin und PAK4 ließen sich zuverlässig nachweisen. „Kommerziell erhältliche Mikroskopsysteme, die für diese Anwendungen zur Verfügung stehen, haben nur einen begrenzten Leistungsbereich und insbesondere eine viel geringere Empfindlichkeit und können nicht zuverlässig zwischen Proteinkristallen und Salzkristallen unterscheiden“, fasst Chang zusammen. „Das von uns beschriebene MPM-System dürfte in der Community der Strukturbiologie, insbesondere in Laboren an Röntgenstrahlungsquellen, aber auch in Institutionen und Laboren, die beispielsweise in der Neurobiologie arbeiten, starkes Interesse finden.“
Die Arbeiten wurden durch den Exzellenzcluster „Advanced Imaging of Matter“ der Deutschen Forschungsgemeinschaft (DFG) - EXC 2056 - Projekt ID 390715994 unterstützt, dem Helmholtz Exzellenz Netzwerk „Structure, Dynamics and Control on the Atomic Scale“, der Helmholtz Young Investigator Group (VH-NG-804), Helmholtz-CAS Joint Research Group (HCJRG 201), dem DFG Projekt BE1443/29-1, sowie durch das Deutsche Zentrum für Luft- und Raumfahrt (DLR) und BMBF über die Projeket 50WB1422,05K16GUA. Die Joachim-Herz Stiftung Hamburg unterstützte diese Arbeit ebenfalls über das Projekt Infecto-Physics.
Originalveröffentlichung:
Protein-crystal detection with a compact multimodal multiphoton microscope; Qing-di Cheng, Hsiang-Yu Chung, Robin Schubert, Shih-Hsuan Chia, Sven Falke, Celestin Nzanzu Mudogo, Franz X. Kärtner, Guoqing Chang & Christian Betzel; „Communications Biology“, 2020; DOI: 10.1038/s42003-020-01275-8



