URL: https://www.desy.de/infos__services/presse/pressemeldungen/2014/pm_240714/index_ger.html
Breadcrumb Navigation
Antibiotika-Alternative: Mit Viren gegen Bakterien
Röntgenuntersuchung zeigt, wie Bakteriophagen die bakterielle Zellwand angreifen
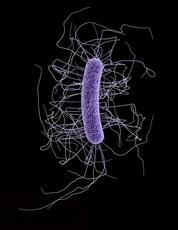
Ein Clostridium-difficile-Bakterium unter dem Elektronenmikroskop. Bild: Jennifer Hulsey/CDC
Hamburg, 24. Juli 2014. Eine Untersuchung an DESYs Röntgenring PETRA III zeigt, wie spezielle Viren den lebensbedrohlichen Durchfallkeim Clostridium difficile abtöten. Die Studie von Forschern der Hamburger Niederlassung des Europäischen Laboratoriums für Molekularbiologie, EMBL, enthüllt, wie bestimmte Enzyme dieser Viren ausgeschüttet werden, um die Zellwand der Bakterien aufzulösen. Die Arbeit eröffnet neue Möglichkeiten für die Entwicklung von Therapien mit sogenannten Bakteriophagen, also auf Bakterien spezialisierten Viren, wie das Team um EMBL-Gruppenleiter Rob Meijers im Fachjournal "PLoS Pathogens" schreibt.
"Angesichts wachsender Antibiotikaresistenzen können Bakteriophagen und ihre Enzyme eine vielversprechende Alternative bieten", erläutert Meijers. "Unsere Ergebnisse können uns helfen, wirkungsvolle, spezialisierte Bakteriophagen zu entwickeln, nicht nur für Infektionen mit Clostridium difficile, sondern für ein breites Spektrum von Bakterien, die für Gesundheit, Landwirtschaft und Lebensmittelindustrie von Bedeutung sind."
Bakteriophagen sind Viren, die Bakterien infizieren und zerstören, ohne andere Organismen anzugreifen. Sie wurden bereits vor mehr als einem Jahrhundert als Behandlungsmöglichkeit für bakterielle Infektionen entdeckt. Mit Einführung der Antibiotika schwand jedoch das Interesse an den medizinisch schwieriger anzuwendenden Bakteriophagen. Durch die zunehmenden Antibiotikaresistenzen erlebt die Forschung an Bakteriophagen derzeit jedoch einen Aufschwung.
Das Bakterium Clostridium difficile wird wegen zunehmender Resistenzen in vielen Kliniken und anderen Gesundheitseinrichtungen zu einem ernsthaften Problem. Es kann lebensgefährliche Durchfälle auslösen, insbesondere bei Patienten, die aus anderen Gründen eine Breitspektrum-Antibiotikatherapie erhalten. Clostridium difficile gehört zur normalen menschlichen Darmflora und ist für gesunde Menschen unproblematisch. Bei einer Behandlung mit Antibiotika wird jedoch ein Großteil der normalen Darmflora abgetötet, so dass sich die widerstandfähigeren Clostridium-difficile-Keime unter Umständen unkontrolliert vermehren können, was zu Komplikationen wie schweren Fällen von Durchfall führen kann. Die gemeldete Zahl solcher schweren Verläufe hat sich nach Daten des Berliner Robert Koch-Instituts von 2008 bis 2013 in Deutschland verdreifacht.
Diese Fälle sind oft schwer zu behandeln, weil die Durchfallkeime auf viele Antibiotika nicht mehr ansprechen. Eine mögliche Behandlungsalternative wären Bakteriophagen. Diese Viren dringen in Bakterienzellen ein und vermehren sich, bis die Zelle aufbricht und frische Bakteriophagen ausschüttet. Im Gegensatz zu Antibiotika sind Bakteriophagen hochspezialisiert auf das Ziel, das sie angreifen. Allerdings sind sie schwer zu kontrollieren, und auch gegen Bakteriophagen können Bakterien rasch Resistenzen entwickeln. Für die Entwicklung einer wirksamen Therapie mit Bakteriophagen müssen Forscher daher den Lebenszyklus dieser Viren noch genauer verstehen - insbesondere, wie die Viren die Zellwand der Bakterien zerstören. Zwar ist bekannt, dass die Bakteriophagen dazu Enzyme namens Endolysine produzieren. Wie diese Enzyme jedoch aktiviert werden, ist ein fehlender wichtiger Stein des Puzzles.
Mit dem intensiven Röntgenlicht von DESYs Forschungslichtquelle PETRA III haben die Wissenschaftler nun einen Aktivierungsmechanismus von Endolysinen entdeckt, die Bakterien der Gattung Clostridium angreifen. "Diese Enzyme scheinen von einer gestreckten, unter Spannung stehenden Form, bei der je ein Paar von Endolysinen verknüpft ist, zu einem gelösten Zustand umzuschalten, in dem beide Endolysine Seite an Seite liegen", erläutert EMBL-Forscher Matthew Dunne. "Das Umschalten von einem Zustand zum anderen setzt das Enzym frei, das dann beginnt, die bakterielle Zellwand abzubauen." Sobald die Zellwand anfängt zusammenzubrechen, kann die Bakterienzelle dem inneren Druck nicht mehr standhalten, explodiert und setzt die neuen Bakteriophagen frei, die wiederum weitere Bakterienzellen infizieren.
Gemeinsam mit Melinda Mayer und Arjan Narbad vom britischen Institut für Lebensmittelforschung in Norwich haben die Wissenschaftler zwei unterschiedliche Endolysine verglichen: Eines von Bakteriophagen, die Clostridium difficile angreifen, und ein anderes, das die Zellwand von Clostridia-Keimen verdaut, die Probleme in der Käseproduktion verursachen. Mit Röntgenkristallographie und weiteren Techniken der Strukturbiologie konnten die Forscher an der EMBL-Messstation auf dem Hamburger DESY-Campus die dreidimensionale Struktur der Enzyme bestimmen und so auf ihre Funktionsweise schließen.
"Bemerkenswerterweise konnten wir beobachten, dass beide Endolysine einen gemeinsamen Aktivierungsmechanismus besitzen", berichtet Dunne. Daraus folgern die Forscher, dass der Übergang vom gespannten zum gelösten Zustand wahrscheinlich eine häufige Taktik ist. Diese Erkenntnis könnte möglicherweise dazu dienen, weitere Viren zu Verbündeten im Kampf gegen andere antibiotikaresistente Bakterien zu machen.
Das Europäische Laboratorium für Molekularbiologie (EMBL) ist Europas führendes Grundlagenforschungsinstitut in den Lebenswissenschaften, das sich über öffentliche Forschungsgelder seiner Mitgliedstaaten finanziert. Mehr als 80 unabhängige internationale Forschungsgruppen arbeiten hier interdisziplinär zu Themen des gesamten Spektrums der Molekularbiologie. Die 1700 Mitarbeiter des Instituts arbeiten an fünf Standorten: das Hauptlaboratorium in Heidelberg sowie Außenstellen in Hinxton bei Cambridge (Europäisches Bioinformatik-Institut), Grenoble, Hamburg und Monterotondo bei Rom.
Das Deutsche Elektronen-Synchrotron DESY ist das führende deutsche Beschleunigerzentrum und eines der führenden weltweit. DESY ist Mitglied der Helmholtz-Gemeinschaft und wird zu 90 Prozent vom BMBF und zu 10 Prozent von den Ländern Hamburg und Brandenburg finanziert. An seinen Standorten in Hamburg und Zeuthen bei Berlin entwickelt, baut und betreibt DESY große Teilchenbeschleuniger und erforscht damit die Struktur der Materie. Die Kombination von Forschung mit Photonen und Teilchenphysik bei DESY ist einmalig in Europa. Das Center for Free-Electron Laser Science CFEL ist eine Kooperation von DESY, Universität Hamburg und der Max-Planck-Gesellschaft.
Originalveröffentlichung
“The CD27L and CTP1L endolysins targeting Clostridia contain a built-in trigger and release factor”; Matthew Dunne, Haydyn D. T. Mertens, Vasiliki Garefalaki, Cy M. Jeffries, Andrew Thompson, Edward A. Lemke, Dmitri I. Svergun, Melinda J. Mayer, Arjan Narbad and Rob Meijers; "PLoS Pathogens", 2014; DOI: 10.1371/journal.ppat.1004228
Wissenschaftliche Ansprechpartner
Rob Meijers, European Molecular Biology Laboratory, Hamburg, +49 40 89902-243; r.meijers@embl-hamburg.de
Pressekontakt
DESY-Pressesprecher Thomas Zoufal, +49 8998-1666, presse@desy.de
Bilder
|
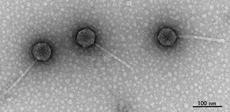
Die untersuchten Bakteriophagen unter dem Elektronenmikroskop. Bild: Kathryn Cross/IFR |
Die untersuchten Endolysine werden aktiviert, indem sie von einem gestreckten Zustand (links) in einen gelösten (rechts) umschalten. Bild: Rob Meijers/EMBL |