URL: https://www.desy.de/infos__services/presse/pressemeldungen/2012/pm_310512/index_ger.html
Breadcrumb Navigation
Röntgenlaser-Technik ebnet den Weg zu neuen biologischen Erkenntnissen
Erste hochauflösende Strukturanalyse von Biomolekülen zeigt Potenzial von Freie-Elektronen-Lasern
Diffraktionsbild eines Lysozym-Mikrokristalls im Röntgenlaser. Bild: Anton Barty/DESY
Hamburg, 31. Mai 2012. Ein internationales Forscherteam hat erstmals die innere Struktur eines Biomoleküls hochaufgelöst mit einem Röntgenlaser analysiert. Die Studie an der Linac Coherent Light Source (LCLS) des US-Beschleunigerzentrums SLAC demonstriere das enorme Potenzial sogenannter Freie-Elektronen-Laser (FEL) für die Strukturbiologie, schreiben die Wissenschaftler im US-Fachjournal „Science“. Das internationale Team, darunter Forscher vom Center for Free-Electron Laser Science (CFEL) auf dem DESY-Campus in Hamburg, entzifferte die Struktur des Enzyms Lysozym aus dem Hühnereiweiß auf 0,19 Nanometer genau. Lysozym ist ein extrem gut untersuchtes Biomolekül, das in der aktuellen Studie als Modellsystem diente, um die Genauigkeit der Methode zu belegen, wie die Forscher um Sébastien Boutet vom SLAC betonen.
„Die außergewöhnlich intensiven Röntgenblitze von FELs ermöglichen die Analyse ganz neuer Klassen von Biomolekülen wie etwa Proteinen aus der Zellmembran, die sich nur schwer oder fast gar nicht kristallisieren lassen“, unterstreicht Ko-Autor und CFEL-Forscher Henry Chapman vom DESY. „Das erlaubt uns, unkartiertes Gelände der Biologie zu erkunden.“ Das CFEL ist ein Gemeinschaftsunternehmen von DESY, der Max-Planck-Gesellschaft und der Universität Hamburg.
Die Struktur von Biomolekülen ist von großer Bedeutung für Medizin und Biologie, denn ihre Form bestimmt oft über ihre Funktion. Ausgehend von der Struktur eines Enzyms, das etwa für einen Zellrezeptor eine entscheidende Rolle spielt, lässt sich unter Umständen ein maßgeschneidertes Medikament entwickeln. Bisher werden solche Strukturen üblicherweise mit der Röntgenkristallographie an Synchrotronstrahlungsquellen untersucht. Doch dafür sind vergleichsweise große und sehr regelmäßige Kristalle der Probensubstanz nötig. Die Röntgenstrahlung wird an dem regelmäßigen Kristallgitter gestreut, und dieses Beugungsmuster gibt Aufschluss über die Struktur des Kristalls. Viele Biomoleküle sind jedoch nur schwer zu kristallisieren und nicht sehr widerstandsfähig gegen Röntgenstrahlung.
Neuartige Röntgenlaser wie die LCLS oder der in Hamburg im Bau befindliche europäische Röntgenlaser European XFEL bieten die Chance, solche bislang unzugänglichen Strukturen zu untersuchen. Denn die Röntgenblitze dieser Instrumente sind so hell, dass bereits winzigste Kristalle ausreichen, um gute Beugungsbilder aufzunehmen. Allerdings werden die Proben durch das intensive Röntgenlicht nahezu sofort zerstört. Vor dem Verdampfen der Probe lassen sich jedoch noch exzellente Beugungsbilder aufnehmen. „Wir konnten zeigen, dass sich hochaufgelöste Informationen aufnehmen lassen, bevor Strahlungsschäden wirksam werden“, erläutert Anton Barty aus der Gruppe von Chapman. „Der Schlüssel sind die ultrakurzen Pulse – es zeigt sich kein Schaden, bevor der Röntgenpuls nicht schon vorbei ist.“
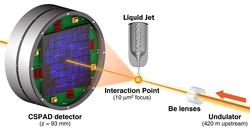
Die verwendeten Röntgenblitze waren bis zu fünf Femtosekunden kurz. Eine Femtosekunde ist der billiardste Teil einer Sekunde. Da die Proben von den Blitzen zerstört werden, verwendeten die Forscher statt eines einzelnen, großen Kristalls Millionen Mikrokristalle mit typischen Abmessungen von einem mal einem mal drei Mikrometern (tausendstel Millimetern), die sie in einer Lösung senkrecht durch den Laser fließen ließen. Unter etwa 3,5 Millionen Röntgenblitzen registrierten die Forscher rund 100 000 Treffer, aus denen sich die Lysozym-Struktur schließlich berechnen und mit früheren Analysen von sehr viel größeren Lysozym-Kristallen vergleichen ließ. „Die gute Übereinstimmung macht die Methode zu einem wertvollen Werkzeug für Systeme, bei denen sich nur winzige Kristalle gewinnen lassen“, unterstreicht Ko-Autorin Ilme Schlichting vom Max-Planck-Institut für medizinische Forschung in Heidelberg.
Die Forscher hatten die Methode zuvor mit anderen Biomolekülen ausprobiert. Diese Untersuchungen hatten allerdings noch nicht die hohe Auflösung erreicht, die für neue Erkenntnisse in der Strukturbiologie nötig ist. Dank eines neuen Instruments an der LCLS, dem Coherent X-ray Imaging Instrument (CXI) konnten sie nun Röntgenstrahlung mit einer Wellenlänge von 0,132 Nanometern analysieren. Zum Vergleich: Sichtbares Licht hat Wellenlängen zwischen 400 und 800 Nanometern (ein Nanometer ist der millionste Teil eines Millimeters). Die Wellenlänge der verwendeten Strahlung bestimmt die Detailgröße, die sich noch erkennen lässt. „Wir können die intensiven LCLS-Pulse nutzen, um die Struktur des Moleküls so fein abzubilden, dass wir beginnen, auf die Position einzelner Atome schließen zu können“, betont Erstautor Sébastien Boutet. „Diese wichtige Demonstration zeigt, dass die Technik funktioniert, und sie ebnet den Weg für eine Vielzahl spannender künftiger Experimente.“
Über das CFEL
Das Center for Free-Electron Laser Science (CFEL) auf dem Forschungscampus Hamburg-Bahrenfeld ist eine Kooperation des Deutschen Elektronen-Synchrotrons DESY, der Max-Planck-Gesellschaft und der Universität Hamburg. Es beschäftigt sich mit der Forschung an sogenannten Freie-Elektronen-Lasern (FEL). Diese neuartigen Lichtquellen auf der Basis von linearen Teilchenbeschleunigern ermöglichen, die Natur auf der Skala einzelner Moleküle und Atome live zu beobachten. Unter dem Dach des CFEL treffen sich führende Forscher verschiedener Disziplinen, um gemeinsam an übergreifenden Themen zu arbeiten. Die gegenwärtig über 140 CFEL-Mitarbeiter bilden dabei fünf Divisionen und zwei sogenannte Advanced Study Groups. http://www.cfel.de
Über LCLS
Der Röntgenlaser LCLS (Linac Coherent Light Source) ist eine vom US-Energieministerium finanzierte Großforschungsanlage am Beschleunigerzentrum SLAC in Kalifornien. LCLS ist der erste Freie-Elektronen-Laser für harte Röntgenstrahlung und eröffnet Forschern den Blick auf atomare Details und ultrakurze Prozesse in der Nanowelt. LCLS ermöglicht wegweisende Forschung in der Physik, der Chemie, der Strukturbiologie, der Energieforschung und auf zahlreichen weiteren Feldern. http://lcls.slac.stanford.edu
Originalveröffentlichung
"High-Resolution Protein Structure Determination by Serial Femtosecond Crystallography"; Sébastien Boutet et al.; "Science", DOI: 10.1126/science.1217737
Pressekontakt
DESY-Sprecher Dr. Thomas Zoufal, Tel. +49 40 8998-1666, presse@desy.de
Wissenschaftliche Ansprechpartner (englisch)
Prof. Henry Chapman, Center for Free-Electron Laser Science (CFEL), Tel. +49 40 8998-4155, henry.chapman@desy.de
Dr. Anton Barty, Center for Free-Electron Laser Science (CFEL), Tel. +49 40 8998-5783, anton.barty@desy.de
Bilder
|
|
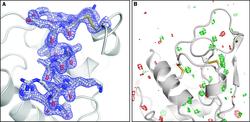
A) Berechnete Elektronendichte des Lysozyms mit 0,19 Nanometern Auflösung. B) Der Vergleich mit Strukturdaten aus der Synchrotronstrahlungsanalyse zeigt keinerlei interpretierbaren Abweichungen (rote und grüne Bereiche). Bild: Thomas R. M. Barends/Max-Planck-Institut für Medizinische Forschung |
|
Koloriertes Beugungsbild eines Röntgenblitzes an einem Lysozym-Mikrokristall. Bild: Anton Barty/DESY |
Koloriertes Beugungsbild eines Röntgenlaserblitzes an einem Lysozym-Mikroskristall. Bild: Anton Barty/DESY |
|
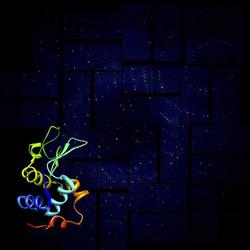
Ein gerendertes Lysozym-Molekül und sein Beugungsbild im Röntgenlaser. Bild: Anton Barty/DESY |