URL: https://www.desy.de/infos__services/presse/pressemeldungen/2012/pm_211012/index_ger.html
Breadcrumb Navigation
Forscher entdecken Turbo-Schalter der Kalziumpumpe in biologischen Zellen
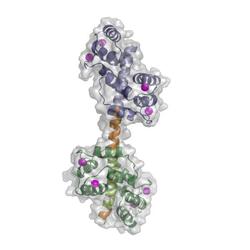
Struktur des Kalziumpumpenschalterkomplexes in der Zelle der Ackerschmalwand (Arabidopsis thaliana).
Hamburg, 21. Oktober 2012. Die lebenswichtige Kalziumpumpe in unseren Körperzellen besitzt einen Turbo-Schalter. Das hat ein dänisch-britisches Forscherteam bei Untersuchungen an der Hamburger DESY-Röntgenlichtquelle DORIS und der Europäischen Synchrotronstrahlungsquelle ESRF in Grenoble entdeckt. Der Ein-Aus-Schalter der Pumpe hat demnach noch eine zuvor unbekannte dritte Stellung, bei der die Pumpe in den Turbo-Gang schaltet. Die Gruppe um Henning Tidow von der Universität Aarhus und Lisbeth Poulsen von der Universität Kopenhagen stellt ihre Untersuchungen im britischen Fachjournal „Nature“ vor (online vorab veröffentlicht). „Die Entdeckung verbessert nicht nur das Verständnis eines fundamentalen Mechanismus in der Biologie aller höheren Lebewesen, sondern könnte auch einmal eine bessere Behandlung bestimmter Krankheiten ermöglichen, bei denen der Kalziumhaushalt gestört ist“, betont Tidow. Die Forscher hatten die Messstation des Europäischen Molekularbiologie-Labors EMBL an DORIS genutzt.
Das Element Kalzium spielt bei zahlreichen Lebensprozessen eine zentrale Rolle, etwa bei der Zellteilung, dem Tag-Nacht-Rhythmus und bei der Kommunikation von Zellen. Entscheidend ist dabei ein Gefälle der Kalziumkonzentration, die normalerweise außerhalb der Zelle hoch und in der Zelle niedrig ist. Für dieses Gefälle sorgt unter anderem eine Kalziumpumpe, die in allen höheren Organismen (Eukaryoten) vorkommt – von der Brennnessel bis zum Blauwal. Beispielsweise unter Stress steigt die Kalziumkonzentration in der Zelle an und löst damit eine entsprechende Reaktion aus. Anschließend muss die Konzentration wieder gesenkt werden.
„Der Kalziumtransport aus der Zelle benötigt viel Energie. Daher ist es wichtig, dass die Pumpe nur aktiviert wird, wenn nötig“, erläutert Poulsen. Die als PMCA (Plasma-Membran-Kalzium-ATPase) bezeichnete Pumpe besitzt daher einen Schalter, der vom Protein Calmodulin betätigt wird. Bindet Kalzium an Calmodulin, ändert es dieses seine Form, so dass es an eine Bindungsstelle der zelleigenen Kalziumpumpe andocken kann und diese somit aktiviert. Steigt die Kalziumkonzentration in der Zelle, werden so mehr und mehr Pumpen angeschaltet.
Die Forscher um Tidow hatten sich den gesamten Schaltkomplex im Röntgenlicht angeschaut, um seine molekulare Struktur zu enthüllen. Die Wissenschaftler wählten dazu den Schaltkomplex aus Zellen der Pflanze Ackerschmalwand (Arabidopsis thaliana), den sie zunächst in Kristallform und anschließend in einer Lösung untersuchten, was der natürlichen Umgebung des Moleküls näher kommt. „Auf der Grundlage dieser Analyse konnten wir ein detailliertes dreidimensionales Modell jenes Bereichs der Kalziumpumpe erstellen, der mit Calmodulin interagiert“, berichtet Tidow. „Zu unserer großen Überraschung stellten wir fest, dass die Kalziumpumpe zwei Bindungsstellen für Calmodulin besitzt und nicht nur eine wie bislang angenommen.“
Der Schaltkomplex besteht demnach aus einer hantelartigen Struktur mit zwei Calmodulin-Bindungsstellen. Um herauszufinden, ob die zweite Bindungsstelle eine biologische Bedeutung hat, testen die Forscher Pumpen, bei denen sie einen Schalter lahmgelegt hatten. Tatsächlich konnten diese Pumpen nicht mehr mit voller Kraft laufen. „Unsere Ergebnisse zeigen, dass die Kalziumpumpe in drei Schritten gesteuert wird“, erläutert Poulsen. „Sie ist aus, wenn kein Calmodulin an den Schaltkomplex gebunden ist. Die Pumpe läuft mit mittlerer Geschwindigkeit, sobald eine Bindungsstelle besetzt ist, und mit voller Geschwindigkeit, wenn an beiden Stellen Calmodulin gebunden ist.“
So wird die Pumpe schrittweise aktiviert, je nachdem, wie viel Kalzium in der Zelle vorhanden ist. Steigt die Kalziumkonzentration an, läuft die Pumpe zunächst energieeffizient mit moderater Geschwindigkeit. Droht das Kalzium eine für die Zelle gefährliche Menge zu erreichen, wirft die Pumpe den Turbo an und ist in der Lage, die Konzentration sehr schnell zu reduzieren.
Bioinformatische Analysen ergaben, dass dieser Doppelschalter nicht nur bei allen Pflanzenarten vorkommt, sondern überhaupt bei allen Zellen mit Zellkern (Eukaryoten) vorhanden ist. „Die Studie zeigt, wie wertvoll die Einbindung der Strukturbiologie in die interdisziplinäre Forschung ist“, betont Poul Nissen von der Universität Aarhus. Als nächstes wollen die Forscher die Struktur der gesamten Kalziumpumpe entschlüsseln.
Originalveröffentlichung
A bimodular mechanism of calcium control in eukaryotes; Henning Tidow, Lisbeth R. Poulsen et al.; Nature 2012 (online vorab veröffentlicht); DOI: 10.1038/nature11539
Wissenschaftliche Ansprechpartner
Henning Tidow, PUMPkin-centret, Universität Aarhus, +45 89425262 het@mb.au.dk
Lisbeth Rosager Poulsen, PUMPkin-centret, Universität Kopenhagen,+45 35332595 lrpo@life.ku.dk
Michael Broberg Palmgren, PUMPkin-centret, Universität Kopenhagen, +45 35332592, palmgren@life.ku.dk
Poul Nissen, Direktor PUMPkin centre, Universität Aarhus, +45 28992295, pn@mb.au.dk
Bilder
|
Diese kristallisierten Proben der Kalzium-Pumpkompexes der Ackerschmalwand (Arabidopsis thaliana) wurden von den Forschern untersucht. |
Struktur des Kalziumpumpenschalterkomplexes in der Zelle der Ackerschmalwand (Arabidopsis thaliana). |